|
Помощь по химии от УфаХимик на других порталах
|
|
| ОнлайнХимик | Дата: Вторник, 09.06.2015, 01:49 | Сообщение # 1 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| Здравствуйте! Если Вы хотите получить от нас помощь по химии (школьная, ОГЭ / ЕГЭ), то смело оставляйте свои задания на нашем форуме http://www.ufahimik.com/forum/15!
В ДАННОЙ ТЕМЕ ПРЕДСТАВЛЕНА НАША ПОМОЩЬ НА ДРУГИХ ПОРТАЛАХ.
ОРФОГРАФИЯ И ПУНКТУАЦИЯ СОХРАНЕНЫ
|
| |
| |
| ОнлайнХимик | Дата: Среда, 10.06.2015, 20:12 | Сообщение # 2 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 1:
Определить степени окисления и дать название веществам:
Ba2Si
K20
CO
Fe2O3
(цифры маленькие)
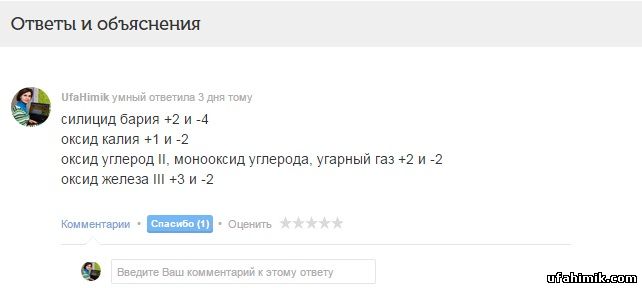
ОТВЕТ:
силицид бария +2 и -4
оксид калия +1 и -2
оксид углерод II, монооксид углерода, угарный газ +2 и -2
оксид железа III +3 и -2
|
| |
| |
| ОнлайнХимик | Дата: Четверг, 11.06.2015, 02:01 | Сообщение # 3 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 2:
1) N2H4+KIO3+KOH=
2) Zn+HN3=
Решить методом электронно-ионного метода!))
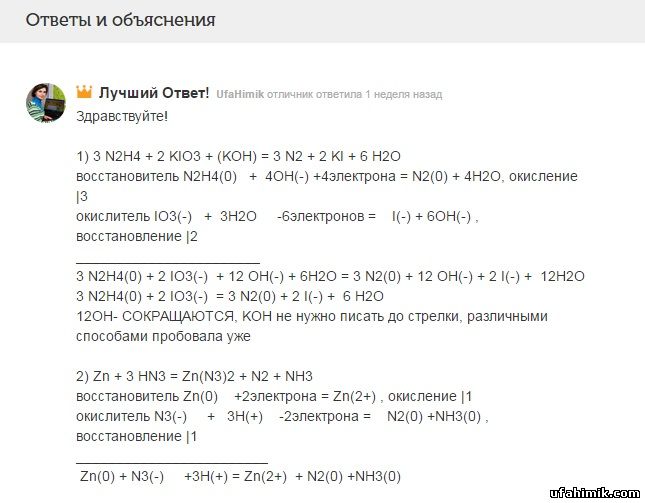
ОТВЕТ:
Здравствуйте!
1) 3 N2H4 + 2 KIO3 + (KOH) = 3 N2 + 2 KI + 6 H2O
восстановитель N2H4(0) + 4OH(-) +4электрона = N2(0) + 4H2O, окисление |3
окислитель IO3(-) + 3H2O -6электронов = I(-) + 6OH(-) , восстановление |2
_______________________
3 N2H4(0) + 2 IO3(-) + 12 OH(-) + 6H2O = 3 N2(0) + 12 OH(-) + 2 I(-) + 12H2O
3 N2H4(0) + 2 IO3(-) = 3 N2(0) + 2 I(-) + 6 H2O
12OH- СОКРАЩАЮТСЯ, KOH не нужно писать до стрелки, различными способами пробовала уже
2) Zn + 3 HN3 = Zn(N3)2 + N2 + NH3
восстановитель Zn(0) +2электрона = Zn(2+) , окисление |1
окислитель N3(-) + 3H(+) -2электрона = N2(0) +NH3(0) , восстановление |1
________________________
Zn(0) + N3(-) +3H(+) = Zn(2+) + N2(0) +NH3(0)
|
| |
| |
| ОнлайнХимик | Дата: Четверг, 11.06.2015, 14:01 | Сообщение # 4 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 3:
перечислить анионы 2 аналитической группы укажите групповой реагент
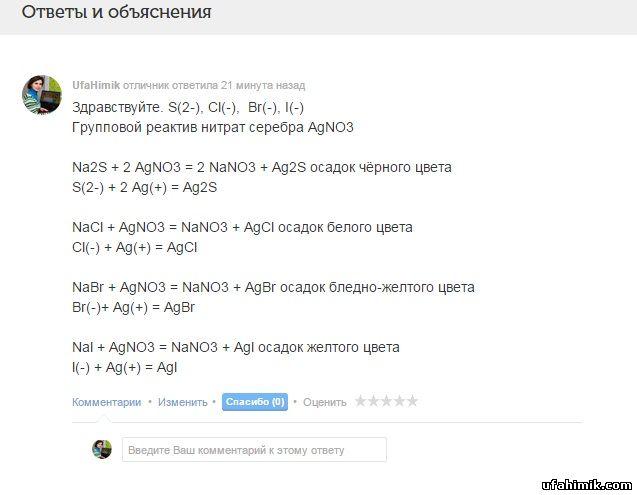
ОТВЕТ:
Здравствуйте. S(2-), Cl(-), Br(-), I(-)
Групповой реактив нитрат серебра AgNO3
Na2S + 2 AgNO3 = 2 NaNO3 + Ag2S осадок чёрного цвета
S(2-) + 2 Ag(+) = Ag2S
NaCl + AgNO3 = NaNO3 + AgCl осадок белого цвета
Cl(-) + Ag(+) = AgCl
NaBr + AgNO3 = NaNO3 + AgBr осадок бледно-желтого цвета
Br(-)+ Ag(+) = AgBr
Nal + AgNO3 = NaNO3 + Agl осадок желтого цвета
l(-) + Ag(+) = Agl
|
| |
| |
| ОнлайнХимик | Дата: Четверг, 11.06.2015, 15:08 | Сообщение # 5 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 4:
ацетат меди написать гидролиз
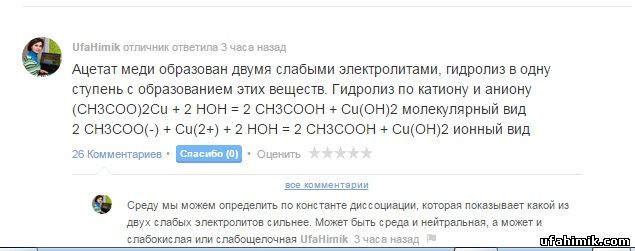
ОТВЕТ:
Ацетат меди образован двумя слабыми электролитами, гидролиз в одну ступень с образованием этих веществ. Гидролиз по катиону и аниону
(CH3COO)2Cu + 2 HOH = 2 CH3COOH + Cu(OH)2 молекулярный вид
2 CH3COO(-) + Cu(2+) + 2 HOH = 2 CH3COOH + Cu(OH)2 ионный вид
Среду мы можем определить по константе диссоциации, которая показывает какой из двух слабых электролитов сильнее. Может быть среда и нейтральная, а может и слабокислая или слабощелочная
K(CH3COOH) = 1,74·10^-5 > K2(Cu(OH)2) = 3,4·10^-7 Следовательно, среда слабокислая
|
| |
| |
| ОнлайнХимик | Дата: Четверг, 11.06.2015, 15:36 | Сообщение # 6 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 5:
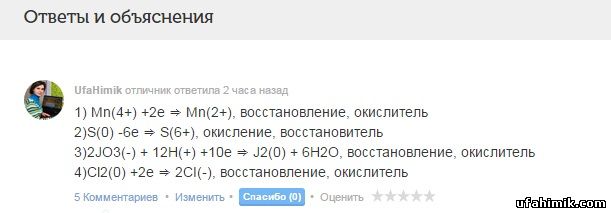
помогите помогите решить задание :Укажите количество принятых или потерянных электронов элементом - окислителем или восстановителем в указанных периодах.
1)Mn4+ ⇒Mn2+
2)S0 ⇒ S6+
3)JO3- ⇒ J2
4)Cl2 ⇒ 2CI-
ОТВЕТ:
1) Mn(4+) +2е ⇒ Mn(2+), восстановление, окислитель
2)S(0) -6е ⇒ S(6+), окисление, восстановитель
3)2JO3(-) + 12H(+) +10е ⇒ J2(0) + 6H2O, восстановление, окислитель
4)Cl2(0) +2е ⇒ 2CI(-), восстановление, окислитель
|
| |
| |
| ОнлайнХимик | Дата: Четверг, 11.06.2015, 15:41 | Сообщение # 7 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 6:
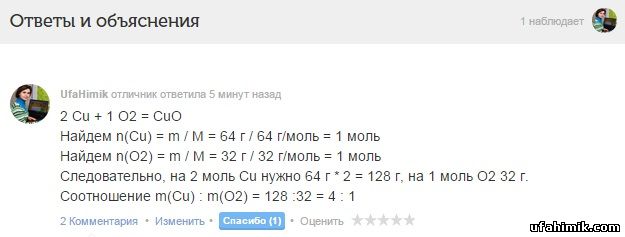
В каком соотношении масс необходимо взять чистые вещества медь и кислород , чтобы они прореагировали без остатка с образованием купрум (2) оксида?
ОТВЕТ:
2 Cu + 1 O2 = CuO
Найдем n(Cu) = m / M = 64 г / 64 г/моль = 1 моль
Найдем n(O2) = m / M = 32 г / 32 г/моль = 1 моль
Следовательно, на 2 моль Cu нужно 64 г * 2 = 128 г, на 1 моль O2 32 г.
Соотношение m(Cu) : m(O2) = 128 :32 = 4 : 1
|
| |
| |
| ОнлайнХимик | Дата: Четверг, 11.06.2015, 16:18 | Сообщение # 8 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 7:
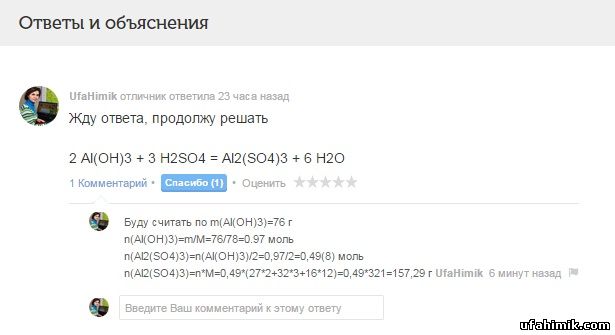
Сколько грамм соли образуется при взаимодействий серной кислоты 76 г гидроксида алюминия.С решение пожалуйся
ОТВЕТ:
Жду ответа (по чему вести расчет, 76 грамм Al(OH)3 или H2SO4?), продолжу решать
2 Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O- Буду считать по m(Al(OH)3)=76 г
n(Al(OH)3)=m/M=76/78=0.97 моль
n(Al2(SO4)3)=n(Al(OH)3)/2=0,97/2=0,49(8) моль
n(Al2(SO4)3)=n*M=0,49*(27*2+32*3+16*12)=0,49*321=157,29 г
|
| |
| |
| ОнлайнХимик | Дата: Пятница, 12.06.2015, 03:35 | Сообщение # 9 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 8:
Помогите пжл. Приведите одно химическое уравнение и досконально объясните как находить коэффициенты и.т.д Очень прошу вас.
ОТВЕТ:
H2SO4 + Al(OH)3 = Al2(SO4)3 + H2O
Данная реакция обмена, ее можно уравнивать или частями, то есть катионы считать (положительно заряженные частицы в таблице растворимости) и анионы (отрицательно заряженные частицы в таблице растворимости) или отдельно: МЕТАЛЛЫ, НЕМЕТАЛЛЫ, ВОДОРОД КИСЛОРОД (такая последовательность обязательно в окислительно-восстановительных реакция, когда два элемента меняют свою степень окисления).
Нам нужно, чтобы количество одного элемента слева было равно количеству справа.... Соответственно, так мы уравняем вещества полностью.
Смотрим Al справа 2,
слева 1 (когда нет коэффициента - большой цифры перед формулой или индекса - маленькой цифры у элемента в формуле).
H2SO4 + 1 Al(OH)3 = Al2(SO4)3 + H2O
Ставим слева перед формулой Al(OH)3 КОЭФФИЦИЕНТ 2
H2SO4 + 2 Al(OH)3 = Al2(SO4)3 + H2O
Смотрим S справа 3, Можем раскрыть скобки в Al2(SO4)3 = Al2S3O12,
слева 1.
1 H2SO4 + Al(OH)3 = Al2(SO4)3 + H2O
Ставим слева перед формулой H2SO4 КОЭФФИЦИЕНТ 3
3 H2SO4 + 2 Al(OH)3 = Al2(SO4)3 + H2O
Смотрим H справа 2,
слева 3 H2SO4 3*2=6 + 2 Al(OH)3 2*3=6. ИТОГО 12. 12 / 2 = 6 ставим перед H2O справа
3 H2SO4 + 2 Al(OH)3 = Al2(SO4)3 + 6 H2O
Смотрим O справа Al2S3O12 + 6 H2O = 18,
слева 3 H2SO4 3*4=12 + 2 AlO3H3 2*3=6 ИТОГО 18
РЕАКЦИЯ УРАВНЕНА:
3 H2SO4 + 2 Al(OH)3 = Al2(SO4)3 + 6 H2O

|
| |
| |
| ОнлайнХимик | Дата: Пятница, 12.06.2015, 03:38 | Сообщение # 10 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 9:
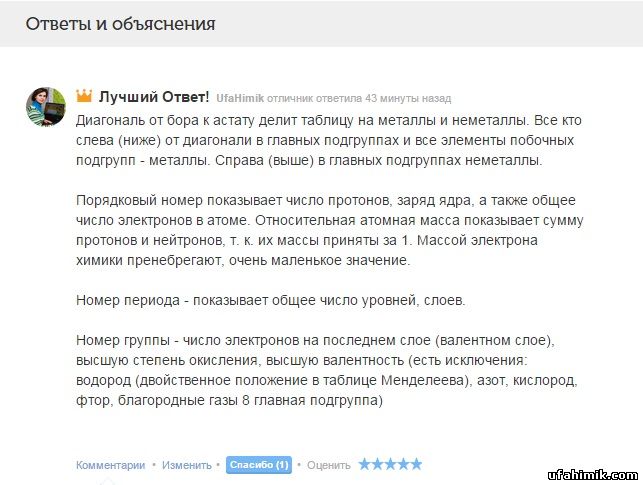
Здравствуйте!Вопрос элементарный,но это химия,поэтому я прошу вас помочь)
Что можно сказать про элемент,глядя только на таблицу Менделеева и как это все оттуда находить. За ответы буду благодарен
ОТВЕТ:
Диагональ от бора к астату делит таблицу на металлы и неметаллы. Все кто слева (ниже) от диагонали в главных подгруппах и все элементы побочных подгрупп - металлы. Справа (выше) в главных подгруппах неметаллы.
Порядковый номер показывает число протонов, заряд ядра, а также общее число электронов в атоме. Относительная атомная масса показывает сумму протонов и нейтронов, т. к. их массы приняты за 1. Массой электрона химики пренебрегают, очень маленькое значение.
Номер периода - показывает общее число уровней, слоев.
Номер группы - число электронов на последнем слое (валентном слое), высшую степень окисления, высшую валентность (есть исключения: водород (двойственное положение в таблице Менделеева), азот, кислород, фтор, благородные газы 8 главная подгруппа)
|
| |
| |
| ОнлайнХимик | Дата: Пятница, 12.06.2015, 05:20 | Сообщение # 11 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 10:
Расположите в порядке возрастания основных свойств следующие вещества : метиламин , триметиламин , анилин.Напишите их формулы , ответ поясните.
ОТВЕТ:
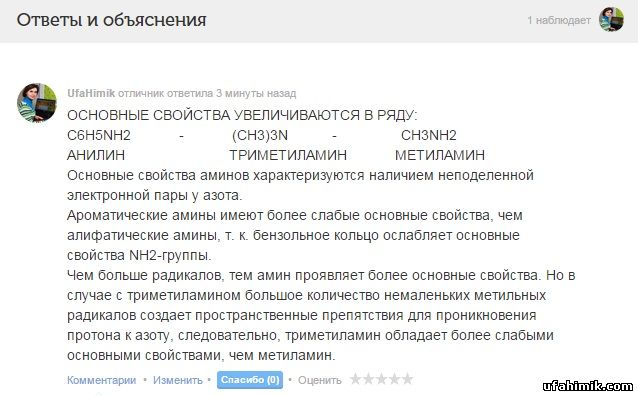
ОСНОВНЫЕ СВОЙСТВА УВЕЛИЧИВАЮТСЯ В РЯДУ:
C6H5NH2 - (CH3)3N - CH3NH2
АНИЛИН ТРИМЕТИЛАМИН МЕТИЛАМИН
Основные свойства аминов характеризуются наличием неподеленной электронной пары у азота.
Ароматические амины имеют более слабые основные свойства, чем алифатические амины, т. к. бензольное кольцо ослабляет основные свойства NH2-группы.
Чем больше радикалов, тем амин проявляет более основные свойства. Но в случае с триметиламином большое количество немаленьких метильных радикалов создает пространственные препятствия для проникновения протона к азоту, следовательно, триметиламин обладает более слабыми основными свойствами, чем метиламин.
|
| |
| |
| ОнлайнХимик | Дата: Пятница, 12.06.2015, 16:33 | Сообщение # 12 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 11:
Написать примеры реакций(хотя-бы по 2 примера):- Замещения: циклоалканы и ароматические углеводороды
- Присоединения: Гидрирование пропилена, соляной кислоты к этилену ( с условиями), хлора к этилену
- Отщепления: дегидрирование этана(отщепление водорода при температуре 300-600,катализатор Al2O3), дегидратация этанола(отщепление воды при температуре 170, катализатор серная кислота), дегидрохлорирование хлорэтана(отщепление хлороводорода в присутствии спиртового растворащелочи)
- Изомеризации: пентана в присутствии хлорида алюминия 450 градусов
ОТВЕТ:
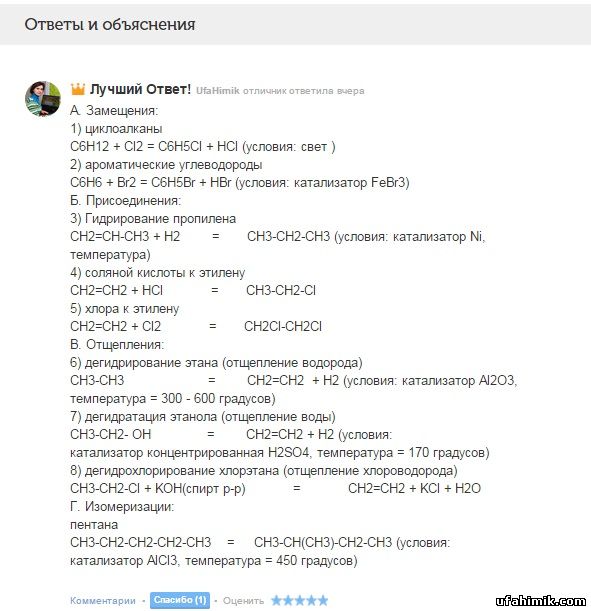
А. Замещения:
1) циклоалканы
C6H12 + Cl2 = C6H5Cl + HCl (условия: свет )
2) ароматические углеводороды
C6H6 + Br2 = C6H5Br + HBr (условия: катализатор FeBr3)
Б. Присоединения:
3) Гидрирование пропилена
CH2=CH-CH3 + H2 = CH3-CH2-CH3 (условия: катализатор Ni, температура)
4) соляной кислоты к этилену
CH2=CH2 + HCl = CH3-CH2-Cl
5) хлора к этилену
CH2=CH2 + Cl2 = CH2Cl-CH2Cl
В. Отщепления:
6) дегидрирование этана (отщепление водорода)
CH3-CH3 = CH2=CH2 + H2 (условия: катализатор Al2O3, температура = 300 - 600 градусов)
7) дегидратация этанола (отщепление воды)
CH3-CH2- OH = CH2=CH2 + H2 (условия: катализатор концентрированная H2SO4, температура = 170 градусов)
8) дегидрохлорирование хлорэтана (отщепление хлороводорода)
CH3-CH2-Cl + KOH(спирт р-р) = CH2=CH2 + KCl + H2O
Г. Изомеризации:
пентана
CH3-CH2-CH2-CH2-CH3 = CH3-CH(CH3)-CH2-CH3 (условия: катализатор AlCl3, температура = 450 градусов)
|
| |
| |
| ОнлайнХимик | Дата: Пятница, 12.06.2015, 16:37 | Сообщение # 13 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 12:
Углеводы. Классификация (моносахариды, дисахариды, полисахариды)
ОТВЕТ:
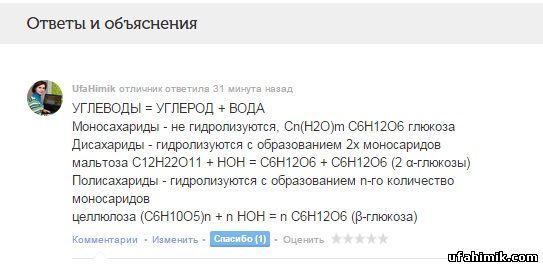
УГЛЕВОДЫ = УГЛЕРОД + ВОДА
Моносахариды - не гидролизуются, Cn(H2O)m C6H12O6 глюкоза
Дисахариды - гидролизуются с образованием 2х моносаридов
мальтоза C12H22O11 + HOH = C6H12O6 + C6H12O6 (2 α-глюкозы)
Полисахариды - гидролизуются с образованием n-го количество моносаридов
целлюлоза (C6H10O5)n + n HOH = n C6H12O6 (β-глюкоза)
|
| |
| |
| ОнлайнХимик | Дата: Пятница, 12.06.2015, 16:39 | Сообщение # 14 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 13:
Атомная (ковалентная) связь, способы ее образования.
ОТВЕТ:
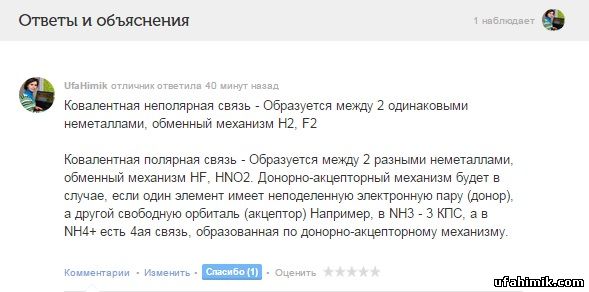
Ковалентная неполярная связь - Образуется между 2 одинаковыми неметаллами, обменный механизм H2, F2
Ковалентная полярная связь - Образуется между 2 разными неметаллами, обменный механизм HF, HNO2. Донорно-акцепторный механизм будет в случае, если один элемент имеет неподеленную электронную пару (донор), а другой свободную орбиталь (акцептор) Например, в NH3 - 3 КПС, а в NH4+ есть 4ая связь, образованная по донорно-акцепторному механизму.
|
| |
| |
| ОнлайнХимик | Дата: Пятница, 12.06.2015, 22:08 | Сообщение # 15 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 14:
Какой объём СО2 выделится при спиртовом брожении 225г глюкозы если образ 200г этилового спирта.
ОТВЕТ:
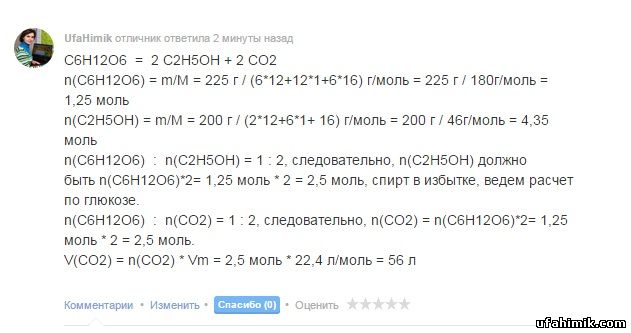
C6H12O6 = 2 C2H5OH + 2 CO2
n(C6H12O6) = m/M = 225 г / (6*12+12*1+6*16) г/моль = 225 г / 180г/моль = 1,25 моль
n(C2H5OH) = m/M = 200 г / (2*12+6*1+ 16) г/моль = 200 г / 46г/моль = 4,35 моль
n(C6H12O6) : n(C2H5OH) = 1 : 2, следовательно, n(C2H5OH) должно быть n(C6H12O6)*2= 1,25 моль * 2 = 2,5 моль, спирт в избытке, ведем расчет по глюкозе.
n(C6H12O6) : n(CO2) = 1 : 2, следовательно, n(CO2) = n(C6H12O6)*2= 1,25 моль * 2 = 2,5 моль.
V(CO2) = n(CO2) * Vm = 2,5 моль * 22,4 л/моль = 56 л
|
| |
| |
| ОнлайнХимик | Дата: Суббота, 13.06.2015, 18:05 | Сообщение # 16 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
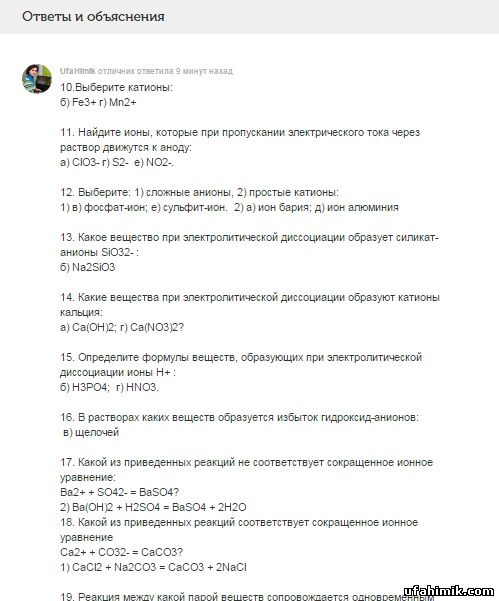
| ЗАДАНИЕ 15:
СРОЧНО!
10. Выберите катионы:а) РO3- ; б) Fe3+; в) МnО4-; г) Мn2+; д) Zn0.
11. Найдите ионы, которые при пропускании электрического тока через раствор движутся к аноду:
а) ClO3- ; б) Са2+; в) NH4+; г) S2-; д) СO2 ; е) NO2-.
12. Выберите: 1) сложные анионы, 2) простые катионы:
а) ион бария; б) сульфид-ион; в) фосфат-ион; г) ион аммония (NH4+);
д) ион алюминия; е) сульфит-ион.
1) _________________ 2)__________________
13. Какое вещество при электролитической диссоциации образует силикат-анионы SiO32- :
a) CaSiO3; б) Na2SiO3; в) H2SiO3; г) SiO2?
14. Какие вещества при электролитической диссоциации образуют катионы кальция:
а) Са(ОН)2; б) СаО; в) СаСО3; г) Ca(NO3)2?
15. Определите формулы веществ, образующих при электролитической диссоциации ионы Н+ :
а) Са(ОН)2; б) Н3РО4; в) H2SiO3; г) HNO3.
16. В растворах каких веществ образуется избыток гидроксид-анионов:
а) кислот; б) солей; в) щелочей?
17. Какой из приведенных реакций не соответствует сокращенное ионное уравнение:
Ba2+ + SO42- = BaSO4?
1) BaCl2 + H2SO4 = BaSO4 + 2HCl 2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
3) 3BaCl2 + Al2(SO4)3 = 3BaSO4 + 2AlCl3 4) Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3
18. Какой из приведенных реакций соответствует сокращенное ионное уравнение
Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl 2) Ca(OH)2 + CO2 + CaCO3 + H2O
3) Ca(HCO3)2 = CaCO3 + CO2 + H2O 4) CaO + CO2 = CaCO3
19. Реакция между какой парой веществ сопровождается одновременным выделением газа и
образованием воды?
1) сульфид натрия и соляная кислота 2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота 4) хлорид натрия и серная кислота
20. Какая пара ионов не может одновременно присутствовать в растворе?
1) Cu2+ и Cl- 2) Cu2+ и S2- 3) Al3+ и SO42- 4) Zn2+ и NO3-
21. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4 2) H2SO4 и Ba(OH)2 3) HNO3 + Ba(OH)2 4) HCl + Ba(OH)2
22. При добавлении какого вещества к раствору гидроксида натрия происходит выделение
газа?
1) NH4Cl 2) CuCl2 3) ZnSO4 4) H3PO4
23. Задача:
По уравнению реакции определите, сколько грамм сульфата бария образуется из 18 грамм
серной кислоты? Уравнение: Ва(NO3)2 + H2SO4 → Ва SO4 + 2HNO3
В1. Соотнесите:
название класса определение: электролитов:
1) основания (щелочи); а) ... образующие при -электролитической диссоциации
в качестве катионов только катионы водорода;
2) соли (средние); б) ... образующие при электролитической диссоциации в качестве
анионов только гидроксид- анионы;
3) кислоты в) ... образующие при электролитической диссоциации
катионы металла (или аммония NH4+) и анионы кислотных остатков.
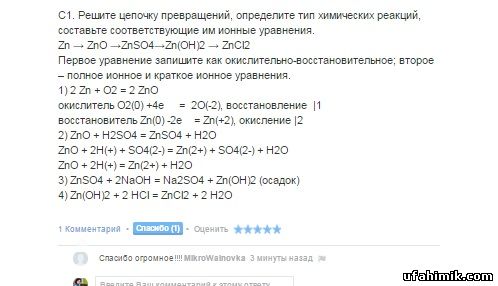
С1. Решите цепочку превращений, определите тип химических реакций, составьте
соответствующие им ионные уравнения.
Zn → ZnO →Zn SO4→Zn (OH)2 → Zn Cl2
Первое уравнение запишите как окислительно-восстановительное; второе – полное ионное и краткое ионное уравнения.
|
| |
| |
| ОнлайнХимик | Дата: Суббота, 13.06.2015, 18:06 | Сообщение # 17 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ОТВЕТ К ЗАДАНИЮ 15!
10.Выберите катионы:
б) Fe3+ г) Мn2+
11. Найдите ионы, которые при пропускании электрического тока через раствор движутся к аноду:
а) ClO3- г) S2- е) NO2-.
12. Выберите: 1) сложные анионы, 2) простые катионы:
1) в) фосфат-ион; е) сульфит-ион. 2) а) ион бария; д) ион алюминия
13. Какое вещество при электролитической диссоциации образует силикат-анионы SiO32- :
б) Na2SiO3
14. Какие вещества при электролитической диссоциации образуют катионы кальция:
а) Са(ОН)2; г) Ca(NO3)2?
15. Определите формулы веществ, образующих при электролитической диссоциации ионы Н+ :
б) Н3РО4; г) HNO3.
16. В растворах каких веществ образуется избыток гидроксид-анионов:
в) щелочей
17. Какой из приведенных реакций не соответствует сокращенное ионное уравнение:
Ba2+ + SO42- = BaSO4?
2) Ba(OH)2 + H2SO4 = BaSO4 + 2H2O
18. Какой из приведенных реакций соответствует сокращенное ионное уравнение
Ca2+ + CO32- = CaCO3?
1) CaCl2 + Na2CO3 = CaCO3 + 2NaCl
19. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
3) карбонат натрия и соляная кислота
20. Какая пара ионов не может одновременно присутствовать в растворе?
2) Cu2+ и S2-
21. При сливании каких двух растворов в воде практически не остается ионов?
1) BaCl2 и Na2SO4
22. При добавлении какого вещества к раствору гидроксида натрия происходит выделение
газа?
1) NH4Cl
23. Задача:
По уравнению реакции определите, сколько грамм сульфата бария образуется из 18 грамм серной кислоты?
Уравнение: Ва(NO3)2 + H2SO4 → ВаSO4 + 2HNO3
n(H2SO4) = m / M = 18г / 98г/моль = 0,18 моль
n(H2SO4) : n(ВаSO4) = 1 : 1 = 0,18 моль
m(ВаSO4) = n(ВаSO4) * M(ВаSO4) = 0.18 моль * 233 г/моль = 41,94 г
В1. Соотнесите:
название класса определение: электролитов:
1) основания (щелочи) - б) ... образующие при электролитической диссоциации в качестве анионов только гидроксид- анионы
2) соли (средние) - в) ... образующие при электролитической диссоциации
катионы металла (или аммония NH4+) и анионы кислотных остатков.
3) кислоты - а)... образующие при -электролитической диссоциации
в качестве катионов только катионы водорода
С1. Решите цепочку превращений, определите тип химических реакций, составьте соответствующие им ионные уравнения.
Zn → ZnO →ZnSO4→Zn(OH)2 → ZnCl2
Первое уравнение запишите как окислительно-восстановительное; второе – полное ионное и краткое ионное уравнения.
1) 2 Zn + O2 = 2 ZnO
окислитель O2(0) +4e = 2O(-2), восстановление |1
восстановитель Zn(0) -2e = Zn(+2), окисление |2
2) ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2H(+) + SO4(2-) = Zn(2+) + SO4(2-) + H2O
ZnO + 2H(+) = Zn(2+) + H2O
3) ZnSO4 + 2NaOH = Na2SO4 + Zn(OH)2 (осадок)
4) Zn(OH)2 + 2 HCl = ZnCl2 + 2 H2O
|
| |
| |
| ОнлайнХимик | Дата: Суббота, 13.06.2015, 18:07 | Сообщение # 18 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| КАРТИНКИ К ЗАДАНИЮ 15!

|
| |
| |
| ОнлайнХимик | Дата: Суббота, 13.06.2015, 18:35 | Сообщение # 19 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 16:
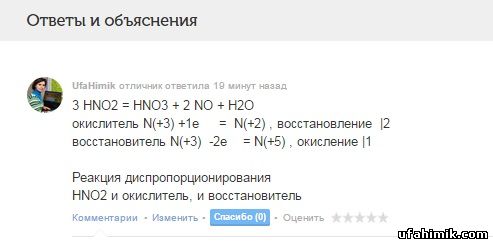
Уровняйте окислительно-восстановительную реакцию методом электронного баланса. укажите окислитель и восстановитель процессы окисления и восстановления.HNO2 = HNO3+NO+H2O
ОТВЕТ:
3 HNO2 = HNO3 + 2 NO + H2O
окислитель N(+3) +1e = N(+2) , восстановление |2
восстановитель N(+3) -2e = N(+5) , окисление |1
Реакция диспропорционирования
HNO2 и окислитель, и восстановитель
|
| |
| |
| ОнлайнХимик | Дата: Суббота, 13.06.2015, 18:37 | Сообщение # 20 |
 Главный мозг
Группа: Администраторы
Сообщений: 269
Статус: Offline
| ЗАДАНИЕ 17:
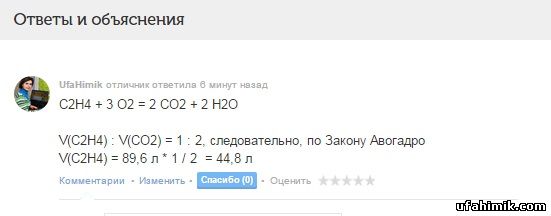
Решите задачу.Рассчитайте какой объём этилена сгорел, если при этом образовалось 89,6 литра углекислого газа ?
ОТВЕТ:
C2H4 + 3 O2 = 2 CO2 + 2 H2O
V(C2H4) : V(CO2) = 1 : 2, следовательно, по Закону Авогадро
V(C2H4) = 89,6 л * 1 / 2 = 44,8 л
|
| |
| |
























